Transcription of 4.4 4.4.1 IDENTIDAD DE LA SUSTANCIA QUÍMICA Acido …
1 IDENTIDAD DE LA SUSTANCIA QU MICA. SINONIMOS. DESCRIPCION. Acido sulf rico COMPOSICI N / INFORMACI N DE LOS INGREDIENTES. PROPIEDADES F SICAS. PROPIEDADES QU MICAS. Incompatibilidades PRODUCCI N, APLICACIONES Y USOS. PRODUCCION. Proceso de C mara Proceso de Contacto APLICACIONES Y USOS. EFECTOS SOBRE LA SALUD. INHALACION. CONTACTO CON PIEL / OJOS. INGESTION. EFECTOS CR NICOS. EFECTOS SIST MICOS. INFORMACI N TOXICOLOGICA. CANCER. EFECTOS REPRODUCTIVOS Y DEL DESARROLLO. EFECTOS GENOTOXICOS. RESPUESTA A ACCIDENTES. PRIMEROS AUXILIOS. Exposici n en Ojos Exposici n en la piel Inhalaci n Ingesti n Rescate INCENDIOS. PROCEDIMIENTOS EN CASO DE DERRAMES O FUGAS. 79. NIVELES PERMISIBLES DE EXPOSICI N OCUPACIONAL.
2 EQUIPO DE PROTECCI N PERSONAL. PROTECCI N RESPIRATORIA. CONDICIONES PARA MANEJO Y ALMACENAMIENTO SEGURO ORIENTADAS A. DISMINUIR EL RIESGO A LA SALUD HUMANA. FRASES DE SEGURIDAD. ALMACENAMIENTO. USOS Y CONTROLES. COMPORTAMIENTO EN EL AMBIENTE. SUELO. AIRE. AGUA. ECOTOXICIDAD. LINEAMIENTOS DE GESTION AMBIENTAL PARA SU DISPOSICION. REDUCCI N DE GENERACI N DE DESECHOS. ALTERNATIVAS PARA TRATAMIENTO Y DISPOSICI N DE DESECHOS. BIBLIOGRAF A. 80. IDENTIDAD DE LA SUSTANCIA QU MICA. F rmula: H2SO4. CAS: 7664-93-9. N mero UN: 1830 (Concentraci n menores de 65,25%). 1832 ( Acido Sulf rico Consumido). 1786 (Mezcla de Acido Sulf rico y Acido Fluorh drico). Clase de Peligro UN: 8 Corrosivos (Soluci n). SIN NIMOS.
3 Acido de bater a, BOV, Acido de Nordhausen, Aceite de Vitriolo, esp ritu del Azufre, Acido Sulf rico, Aceite caf de Vitriolo, Sulfato de Hidr geno, Acido fertilizante, Acido de c mara, Acido de inmersi n, Acido Sulf rico consumido. (2). Sulfuric (sulphuric) Acid (Ingl s), Acide Sulfurique (Franc s), Schwefels ure (Alem n), Acido Solforico (Italiano) . DESCRIPCI N. En su forma pura, el Acido Sulf rico es un l quido aceitoso, sin color y sin olor. Es muy corrosivo. En su forma comercial est usualmente impuro y su coloraci n es pardusca. El Acido Sulf rico puede formar soluciones con el agua en cualquier proporci n. Las soluciones acuosas de Acido Sulf rico se nombran de acuerdo con el porcentaje en peso de Acido en la soluci n; el Acido Sulf rico concentrado (1).
4 Es entonces H2SO4 100%, que se conoce como anhidro o como monohidrato de tri xido de Azufre . El Acido Sulf rico puede disolver cualquier cantidad de tri xido de Azufre (SO3). Al introducir tri xido de Azufre sobre Acido Sulf rico concentrado se genera leum, que por lo general se Acido sulf rico comercializa en soluciones de 10 a 70% de contenido de tri xido de Azufre y que se cono- cen tambi n como Acido Sulf rico fumante (1, 2,11).. H2SO4. COMPOSICI N / INFORMACI N DE LOS INGREDIENTES. Se comercializa en soluci n acuosa de concentraci n entre 33 a 98%. Existen cuatro grados de comercializaci n: comercial, electrolito (de alta pureza para bater as), textil (bajo contenido de impurezas org nicas) o grados de (2).
5 Reactivo . PROPIEDADES F SICAS (1, 2, 7, 10, 11). Tabla 16. Propiedades f sicas para el Acido Sulf rico PROPIEDAD VALOR. Peso Molecular (g/mol) 98,08. Estado f sico L quido Punto de Ebullici n ( C) )(760 mmHg) 290; 100%. 310-335; 98%. Punto de Fusi n ( C) 10,4-10,5; 100%. 3; 98%. -64; 65%. Presi n de Vapor (mmHg) < 0,001; 20 C. 1; 146 C. Gravedad Espec fica (Agua = 1) 1,841; 100%. 81. Tabla 16. Propiedades f sicas para el Acido Sulf rico (continuaci n). PROPIEDAD VALOR. Densidad del Vapor (Aire = 1) 3,4. Velocidad de Evaporaci n (Acetato de Butilo = 1) No Encontrado Solubilidad en Agua (g/ml) Libremente L mites de Inflamabilidad (% vol) No Aplica Temperatura de Auto ignici n ( C) No aplica Punto de Inflamaci n ( C) No Aplica pH ; Soluci n 1 N.
6 1,2; Soluci n 0,1 N. 2,1; Soluci n 0,01 N. PROPIEDADES QU MICAS. El Acido Sulf rico es un Acido mineral fuerte y un oxidante fuerte. Se disocia en agua de acuerdo con dos equilibrios: 1) - H2SO4 + H2O <=> H3O + HSO4. - 2) - HSO4 + H2O <=> H3O + SO42- El primero de ellos a proporciones de agua bajas y el segundo a proporciones altas; por esta raz n el Acido Sulf rico diluido act a como un Acido dib sico. Estas caracter sticas cidas hacen que reaccione con metales b sicos como el aluminio provocando la generaci n de Hidr geno y los correspondientes Sulfatos y biSulfatos met licos. El Acido Sulf rico concentrado y caliente es una SUSTANCIA altamente oxidante y ataca metales preciosos. En este (2).
7 Mismo estado reacciona con carbono, f sforo y Azufre produciendo di xido de Azufre (SO2) . El Acido Sulf rico descompone las sales de muchos otros Acidos, lo cual representa una oportunidad industrial en diversos campos como en la producci n de Sulfato de sodio (Na2SO4) y cloruro de Hidr geno (HCl) a partir del cloruro de sodio (NaCl), la descomposici n de sulfitos a di xido de Azufre y la descomposici n de fosfatos de calcio naturales (1). (Ca3(PO4)2) hasta Acido fosf rico (H3PO4) y Sulfato de calcio (CaSO4) . Sus caracter sticas de higroscopicidad se deben a la formaci n de diferentes hidratos, los cuales corresponden al monohidrato (H2SO4*H2O), el dihidrato (H2SO4*2H2O), el trihidrato (H2SO4*3H2O), el tetrahidrato (H2SO4*4H2O) y (1).
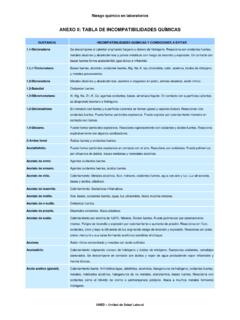
8 Por ltimo el hexahidrato (H2SO4*6H2O) . Las reacciones del Acido Sulf rico concentrado en el rea de los compuestos org nicos est n muy influenciadas por las propiedades oxidantes e higrosc picas de ste; debido a estas caracter sticas, reacciones de carbonizaci n de (1). carbohidratos y de condensaci n org nica presentan mejor desempe o en su presencia . El Acido Sulf rico no es un material combustible en si mismo, pero por ser altamente reactivo es capaz de iniciar la ignici n de sustancias combustibles cuando entra en contacto con ellas. Incompatibilidades Por sus caracter sticas de oxidante fuerte, reacciona violentamente con materiales reductores. Cuando entra en contacto con combustibles finamente particulados provoca su ignici n.
9 Reacciona violentamente con bases. Es corrosivo para muchos metales comunes generando humos de di xido de Azufre e Hidr geno gaseoso, el cual es altamente explosivo. Debido a que es un material muy higrosc pico, puede producir deshidrataci n de otras sustan- cias. Cuando entra en contacto con agua libera grandes cantidades de calor. Al calentarlo se generan Oxidos de 82. (6, 7, 10). Azufre producto de su descomposici n . El contacto de Acido Sulf rico con materiales org nicos como (1, 7). cloratos, carburos, fulminatos o picratos puede causar fuego y explosiones . PRODUCCI N, APLICACIONES Y USOS. (1, 11). PRODUCCI N. Existen dos grandes procesos por los cuales se ha producido o se produce Acido Sulf rico industrialmente: el proceso de c mara y el proceso de contacto.
10 El primero de estos dos fue el m s importante en los primeros a os del siglo XX pero ahora ha ca do en desuso. Proceso de C mara En el proceso de c mara, el xido de Azufre se oxida hasta tri xido de Azufre (SO3), que posteriormente se combina con agua para generar el Acido Sulf rico. Las reacciones involucradas en este proceso corresponden a: 1) - 2NO + O2 => 2NO2. 2) - 2NO2 + 2SO2 + H2O => H2SO4 + 2NO. En estas reacciones el di xido de nitr geno (NO2) act a como el agente oxidante. Los productos finales de este proceso, como se observa, son el Acido Sulf rico y Oxidos de nitr geno. Por este procedimiento se obtiene Acido Sulf rico de concentraci n 78%, que es una de sus desventajas con respecto al proceso de contacto donde se logran concentraciones del producto de 98%.