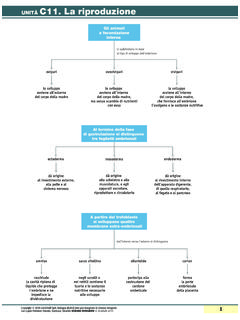
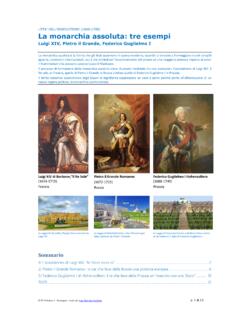
Transcription of Capitolo 5 La quantità chimica: la mole ESERCIZI - Zanichelli
1 ESERCIZI . SUL LIBRO DA PAG 88 A PAG 90. Capitolo 5 La quantit chimica: la mole Quesiti e problemi 1 La massa atomica e la massa 9 Calcola, con l'aiuto della tavola periodica, la mas- . molecolare sa molecolare di SiO2, che il principale costi- 1 Qual la definizione di unit di massa atomica u? tuente del vetro e il minerale pi abbondante del- la crosta terrestre (il quarzo). 60,09 u . a) uguale a 1/12 della massa dell'atomo di 12C. b) uguale a 1/16 della massa dell'atomo di ossi- 10 Calcola la massa molecolare di tre acidi piuttosto . geno comuni: l'acido acetico, CH3 COOH; l'acido clori- c) la massa di un atomo di carbonio drico, HCl; l'acido carbonico, H2CO3. d) la massa di un atomo di idrogeno 60,06 u; 36,46 u; 62,03 u 2 Vero o falso? 11 La fotosintesi consuma CO2 e H2O e produce O2 e.
2 A) La massa atomica di un elemento la C6H12O6. Calcola le masse molecolari delle so- massa relativa rispetto all'atomo 14C. v . f stanze coinvolte in questo processo. Qual quella che ha massa molecolare minore? Una fra queste b) Per determinare la massa molecolare si fa un elemento: quale? Coincide con la sostanza la somma delle masse atomiche degli pi leggera? H2O; O2; no atomi che compongono la molecola.. vf 12 Consultando la tavola periodica, ordina, in base c) Due chiodi di ferro di forma diversa, . alla massa molecolare crescente, i seguenti com- ma con lo stesso peso, contengono lo posti, comunemente disponibili nella maggior stesso numero di atomi.. vf parte delle case (non sempre puri e spesso in so- 3 La massa atomica relativa del piombo uguale a luzione).
3 207,2. Ci significa che a) acqua, H2O. a) la massa relativa di un atomo di piombo b) sale da cucina, NaCl 207,2 volte maggiore di quella di un atomo di c) zucchero da tavola, C12H22O11. carbonio-12 d) bicarbonato di sodio, NaHCO3. b) la massa relativa di un atomo di piombo vale e) candeggina, NaClO. 207,2 g f) ammoniaca, NH3.. c) la massa relativa di un atomo di piombo 207,2 g) etanolo (alcol etilico), CH3CH2OH. volte maggiore della dodicesima parte di un h) metano, CH4. atomo di 12C i) smacchiatore per ruggine e frutta, HF. d) la massa relativa di un atomo di piombo l) acido acetilsalicilico (aspirina), C9H8O4. 207,2 volte maggiore di quella di un atomo di m) acqua ossigenata, H2O2. idrogeno Controlla poi quali di queste sostanze sono pre- senti in casa tua; verifica sulle etichette se sono in- 4 Definisci la massa atomica relativa e la sua unit.
4 Dicati gli usi del prodotto e se sono riportate spe- di misura. cifiche forme di cautela per la loro conservazione 5 Spiega la differenza tra massa atomica relativa e e per il loro uso. h, f, a, i, m, g, b, e, d, l, c . massa molecolare relativa. 6 Calcola le masse molecolari dei seguenti composti. 2 Contare per moli . a) H2SO4 b) Mg3(PO4)2. 13 Definisci la costante di Avogadro. c) HNO3 d) Ca(ClO4)2 . e) NaOH f) Al2(SO4)3 14 Vero o falso? . g) Na2SO4 h) Ca(NO3)2 a) Una mole di atomi contiene un numero di a) 98,09 u; b) 262,87 u; c) 63,02 u; atomi uguale alla costante di Avogadro. vf d) 238,98 u; e) 40,00 u; f) 342,17 u; b) Una mole di molecole contiene un g) 142,05 u; h) 164,10 u numero di molecole uguale alla somma 7 Calcola il peso formula del composto ionico KCl.
5 Delle masse degli atomi che costituiscono . 74,55 u la molecola. v . f c) 1 mol di H2O contiene 6,022 1023. 8 La molecola del metano ha un rapporto di combi- atomi di idrogeno. v . f . nazione tra gli atomi di C e H di 1:4. Determina la d) 6,022 1023 molecole di CO2 hanno massa sua massa molecolare. 16,05 u uguale a 6,022 1023 molecole di H2O. v . f 1 Copyright 2010 Zanichelli Editore Spa, Bologna [6223]. Questo file una estensione online del corso Valitutti, Tifi, Gentile La riproduzione di questa pagina autorizzata ai soli fini dell'utilizzo nell'attivit didattica degli alunni delle classi che hanno adottato il testo ESPLORIAMO LA CHIMICA Zanichelli 2010. ESERCIZI Capitolo 5 La quantit chimica: la mole 15 Qual l'unit di misura della quantit di sostanza c) 28 g/molecola.
6 Nel SI? mole d) 28 g/mol 6,022 1023 molecole/mol =. 16 Qual l'unit di misura della massa molare nel SI? = 1,7 1025 g/mol . g/moli, simbolo g/mol 27 Un campione di O2 contiene 3,01 1024 molecole.. 17 Qual la massa molare dei seguenti elementi? A quante moli corrispondono? 5,00 mol . a) zinco 65,37 g/mol b) oro 197,0 g/mol 28 Calcola il numero di atomi di ossigeno contenuti c) mercurio 200,6 g/mol d) argento 107,9 g/mol . in 50 g di MgSO4. 1,0 1024 atomi di O. 18 Due metalli sconosciuti hanno massa molare ri- 29 Se una mole di ammoniaca, NH3, corrisponde a spettivamente di 47,90 g/mol e 65,38 g/mol. Di che . 17,03 g, quante molecole sono contenute in 170,3 mg metalli si tratta? titanio e zinco di questa sostanza? 19 Quanti grammi devi pesare per avere 10 mol di a) 6,022 1024.
7 Zolfo? 320,7 g b) 6,022 1023. 20 Quante moli ci sono in 84,5 g di argon? 2,12 mol c) 6,022 1022.. 21 A quanti grammi corrispondono 30,0 mol di am- 6,022 1021. d).. moniaca (NH3)? 511 g 30 Quanti grammi di azoto vi sono in 3,50 mol di fo- . 22 Calcola quante moli contiene un campione di 25,0 g sfato di ammonio, (NH4)3PO4? E in 3,50 mol di . delle seguenti sostanze: nitrato di ammonio, NH4NO3? Quale composto ne contiene in quantit maggiore? a) NaI 0,167 mol b) CuSO4 0,157 mol a) 147 g; b) 98,1 g; c) (NH4)3PO4. c) CH4 1,56 mol d) HI 0,195 mol 31 Un accendino a gas contiene 30 g di propano, 23 2,24 mol di una sostanza sconosciuta pesano 391 g.. C3H8. Quanti atomi di idrogeno e di carbonio vi . Qual la massa molecolare della sostanza? sono nell'accendino? 3,3 1024; 1,3 1024.
8 175 u 24 Calcola il numero di atomi contenuti in 32 19,44 1023 molecole di un composto equivalgono . a una massa di 315 g. Determina la massa moleco- a) 0,875 mol di piombo 5,27 1023. lare del composto. 97,6 u b) 0,432 mol di rame 2,60 1023. c) 1,45 mol di calcio 8,73 1023 33 Una molecola composta da carbonio e cloro ha . d) 6,00 mol di carbonio 3,61 1024 massa molecolare 154 u. Sapendo che l'atomo di carbonio ha massa atomica 12 u e che nella mole- 25 Quale affermazione errata? cola ne presente uno solo, determina la formula a) Una mole di una sostanza contiene un numero della molecola. CCl4. di particelle elementari pari al numero di ato- mi contenuti in 12 g di carbonio 12C. b) La massa molare di una sostanza uguale alla sua 3 Formule chimiche e composizione massa atomica o molecolare espressa in g/mol.
9 Percentuale c) La massa molare varia a seconda del tipo di 34 Il composto NaCl ha una composizione percen- . sostanza considerata. tuale in cloro del 58,45%. In 50 g di composto la Il numero di particelle contenute in una mole d) percentuale del cloro . varia a seconda del tipo di sostanza considerata.. a) la stessa b) minore 26 Quale delle espressioni che seguono consente di c) maggiore d) la met .. ricavare la massa di una molecola di ossido di car- 35 La candeggina una soluzione di ipoclorito di so- bonio, CO (MM = 28)? . dio, NaClO. Qual la sua composizione percen- 28 g/mol tuale? Na (30,88%); Cl (47,62%); O (21,50%).. a) =. 6,022 1023 molecole/mol 36 Qual la percentuale in massa del potassio nel . = 4,6 10 -23. g/molecola carbonato di potassio, K2CO3? 56,58%.
10 6,022 1023 molecole/mol 37 Un catalizzatore sperimentale usato nella polime- . b) = rizzazione dei composti organici ha formula empi- 28 g/mol rica Co3Mo2Cl. Determina la sua composizione = 0,22 1023 g/molecola percentuale. Co (43,75%); Mo (47,48%); Cl (8,77%). Copyright 2010 Zanichelli Editore Spa, Bologna [6223]. Questo file una estensione online del corso Valitutti, Tifi, Gentile La riproduzione di questa pagina autorizzata ai soli fini dell'utilizzo nell'attivit didattica degli alunni delle classi che hanno adottato il testo 2. ESPLORIAMO LA CHIMICA Zanichelli 2010. Capitolo 5 La quantit chimica: la mole ESERCIZI . 38 Determina le formule empiriche minime dei se- 41 160 g di rame reagiscono con 40 g di ossigeno per . guenti composti utilizzando la composizione per- formare l'ossido rameico.