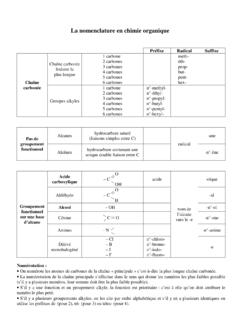
Transcription of Révisions des bases de chimie - Sciences physiques en BTS ...
1 R visions des bases de chimie - page 1 document propos sur le site Sciences physiques en BTS : R visions des bases de chimie Atomes Composition Un atome comporte un noyau et Z lectrons (charge Ze ) A nucl ons dans le noyau : Z protons (charge Z e+) N neutrons (pas de charge) Repr sentation d un atome appartenant l l ment chimique de symbole X : ZAX (avec Z caract ristique de l l ment X) Rq : ZA'X et ZAX sont deux atomes isotopes (m me l ment chimique car m me Z mais pas le m me N) Taille et masse Diam tre : de l ordre de 1010m Masse : de l ordre de 2710kg Classification p riodique des l ments Les l ments chimiques y sont rang s par num ros atomiques (Z) croissants.
2 On entame une nouvelle p riode lorsqu on commence remplir une nouvelle couche . Les l ments d une m me colonne ont le m me nombre d lectrons externes (le nombre d lectrons externes conditionne en grande partie les propri t s chimiques des l ments). Exemples : Remplissage lectronique du potassium et de l argon (l argon est stable car huit lectrons externes soit un octet d lectrons-l h lium est stable avec un duet d lectrons). Ions monoatomiques : Pour tre plus stable, un atome a tendance acqu rir la configuration en octet sur sa couche externe ; exemple du potassium : KK1e+ + (l ion a la configuration en octet de l argon) Autres exemples : 2 MgMg2 e+ + Mais Cl1 eCl + P riode K H He P riode L Li Be B C N O F Ne P riode M Na Mg Al Si P S Cl Ar P riode N K Ca etc.
3 ANZA : nombre de masseZ : num ro atomique=+ Tableau p riodique simplifi E K Z=19 L M K (2) L (8) M (8) N (1) n=4 n=3 n=2n=1 K E K Z=18L M K(2) L(8)M(8)n=3 n=2n=1 Ar E K Z= 2 L M K(2) n=1 He R visions des bases de chimie - page 2 document propos sur le site Sciences physiques en BTS : Mol cules et ions polyatomiques D finition : Une mol cule est une entit chimique form e de plusieurs atomes li s entre eux. Formule brute : elle indique le nombre invariant d atomes de chacun des l ments qui la constitue Exemple : 3NH : la mol cule est constitu e de trois atomes d hydrog ne unis un atome d azote.
4 R gle de l octet (ou ventuellement du duet) Pour leur assurer une meilleure stabilit , les atomes tendent acqu rir une configuration lectronique de leur couche externe en octet (huit lectrons) identique celle du gaz noble le plus proche ; cette configuration peut tre r alis e par tablissement de liaisons de covalence (qui peuvent tre simples, doubles ou triples) avec d autres atomes. Liaison de covalence : Valence des l ments : Le nombre de liaisons de covalence donne la valence de l l ment chimique auquel il appartient.
5 Ci-dessous, quelques valences : El ment chimique hydrog ne oxyg ne chlore carbone azote Valence 1 2 1 4 3 Quelques mol cules (mod les mol culaires et sch mas de Lewis (les liaisons de covalence sont en rouge) : La formation d une liaison covalente simple entre deux atomes r sulte de la mise en commun de deux lectrons par ces deux atomes : ces deux lectrons qui appartiennent aux couches externes des deux atomes forment un doublet de liaison (ou paire liante ou doublet liant).)
6 HH Sch ma de Lewis H H ClCl Cl Cl Sch ma de Lewis N N Sch ma de Lewis NN Sch ma de Lewis O H H O H H O O C Sch ma de Lewis O O C H H H H C H H C H H Sch ma de Lewis N H H H H H N H Sch ma de Lewis R visions des bases de chimie - page 3 document propos sur le site Sciences physiques en BTS : Les ions polyatomiques : Un ion polyatomique est un difice chimique, lectriquement charg , form de plusieurs atomes li s entre eux par des liaisons de covalence. La charge lectrique est r partie sur l ensemble de l ion.
7 Les ions polyatomiques les plus courants (formules et noms) : 3HO+ 4NH+ OH 3NO 3 HCO 23CO 24SO hydronium ammonium hydroxyde nitrate hydrog nocarbonate carbonate sulfate La mole Bilans molaires D finition : Mole et masse molaire : Cons quence : relation entre masse, quantit et masse molaire d une esp ce chimique : masse mesp ()quantit d 'ceesp ceesp ceune ()M()(soit mol)=x Gaz et volume molaire Le volume molaire d un gaz c est le volume d une mole de ce gaz !
8 En chimie , tous les gaz sont parfaits ! Le volume molaire mV d pend des conditions de temp rature et de pression :mVRVn==Tp (*) atm normale20 C et p atm normale50 C et p Volume molaire 122, 4 124, 0 126, 5 (*) : Conditions Normales de Temp rature et de Pression : atm normale0 Cetp Pour viter d employer des nombres gigantesques en d nombrant atomes, mol cules, lectrons,..les chimistes les comptent en moles ! Une mole contient AN entit s : A231N6,0210mol Une mole de tartes c est A23N6,0210tartes Une mole de bonbons c est A23N6, 02 10bonbons La mole est l unit de quantit de mati re (symbole : mol) Cl 35,517 chlore Symbole de l l ment chimique Masse molaire du chlore Nombre atomique (Z) du chlore La masse molaire atomique d un l ment repr sente la masse d une mole d atomes de cet l ment.
9 Elle est indiqu e dans la classification P riodique des l ments : Exemple : 1M(Cl) 35, = La masse molaire d une esp ce chimique, c est la masse d une mole de ce compos . Exemple : M()=++3CM(C)HH4M(H)OM(O) en g 1en g .mol en mol R visions des bases de chimie - page 4 document propos sur le site Sciences physiques en BTS : mVolumeVdecegp, Taz ( )quantit d ' unV( (soit molp)),T=gazx Equation-bilan d une r action : "donne"R actif (s)Produits form s Il faut quilibrer le bilan de la r action en tenant compte de la conservation du nombre d atomes de chaque l ment chimique (en fait, les l ments chimiques se conservent et la masse globale aussi !)
10 Exemple : Combustion compl te du m thane : Les coefficients plac s devant les symboles des esp ces chimiques sont les coefficients stoechiom triques ! Comment lire ce bilan ? Tableau d avancement : Consulter la fiche annexe Concentrations des solutions aqueuses Introduction Dans une solution aqueuse, l eau est le solvant. Souvent : eausolutionVV . Les esp ces introduites sont les solut s. Concentrations molaires Si on introduit un solut dans l eau pour obtenir une solution aqueuse, on peut parler de la concentration de la solution (A1C, C , C.)